Сотрудники научно-исследовательской лаборатории «Экстремальная биология» Научно-клинического центра прецизионной и регенеративной медицины Института фундаментальной биологии и медицины Казанского федерального университета провели научное исследование, посвященное существованию без воды «спящей хирономиды».
Посвященная ему статья была опубликована в престижном журнале Proceedings of the National Academy of Sciences of the United States of America (PNAS). В этой научной статье описывается исследование, над которым работали восемь ученых из разных стран, среди них и специалисты НИЛ "Экстремальная биология" КФУ: ведущий научный сотрудник Олег Гусев, старшие научные сотрудники Елена Шагимарданова и Алина Рябова и научный сотрудник Александр Черкасов.
Обезвоживание является одним из наиболее опасных и потенциально летальных стрессов для живых организмов. Ангидробиоз – это состояние гипометаболизма, связанное с полной остановкой жизненных процессов, которое формируется в ответ на экстремальное обезвоживание.
Наиболее крупным и сложноорганизованным животным, способным прожить без воды, является «спящая хирономида» Polypedilum vanderplanki (Diptera, Chironomidae). Ее личинки обитают в пересыхающих горных водоемах полупустынных зон Западной и Центральной Африки. В этом состоянии они могут выживать почти при полной потере воды и выдерживать широкий спектр других стрессов, возвращаясь к нормальному физиологическому состоянию в течение нескольких часов после восполнения потерянных организмом объемов жидкости.
Феномен ангидробиоза представляет большой интерес в плане изучения фундаментальных вопросов защитных и репарационных систем у живых организмов, а также с точки зрения потенциального применения в биотехнологии.
Несмотря на некоторый прогресс в понимании регуляции ангидробиоза на генетическом уровне, о сопутствующих биохимических изменениях было известно мало. Ученые КФУ провели метаболомное профилирование личинок в состоянии ангидробиоза и после трех часов регидратации. Это понадобилось для определения механизмов, которые позволяют личинкам "спящей хиромиды" переживать экстремальное обезвоживание на уровне простых биохимических реакций.
В качестве модели для сравнения выступали личинки близкородственного вида хирономид Polypedilum nubifer, не обладающие способностью впадать в состояние ангидробиоза.
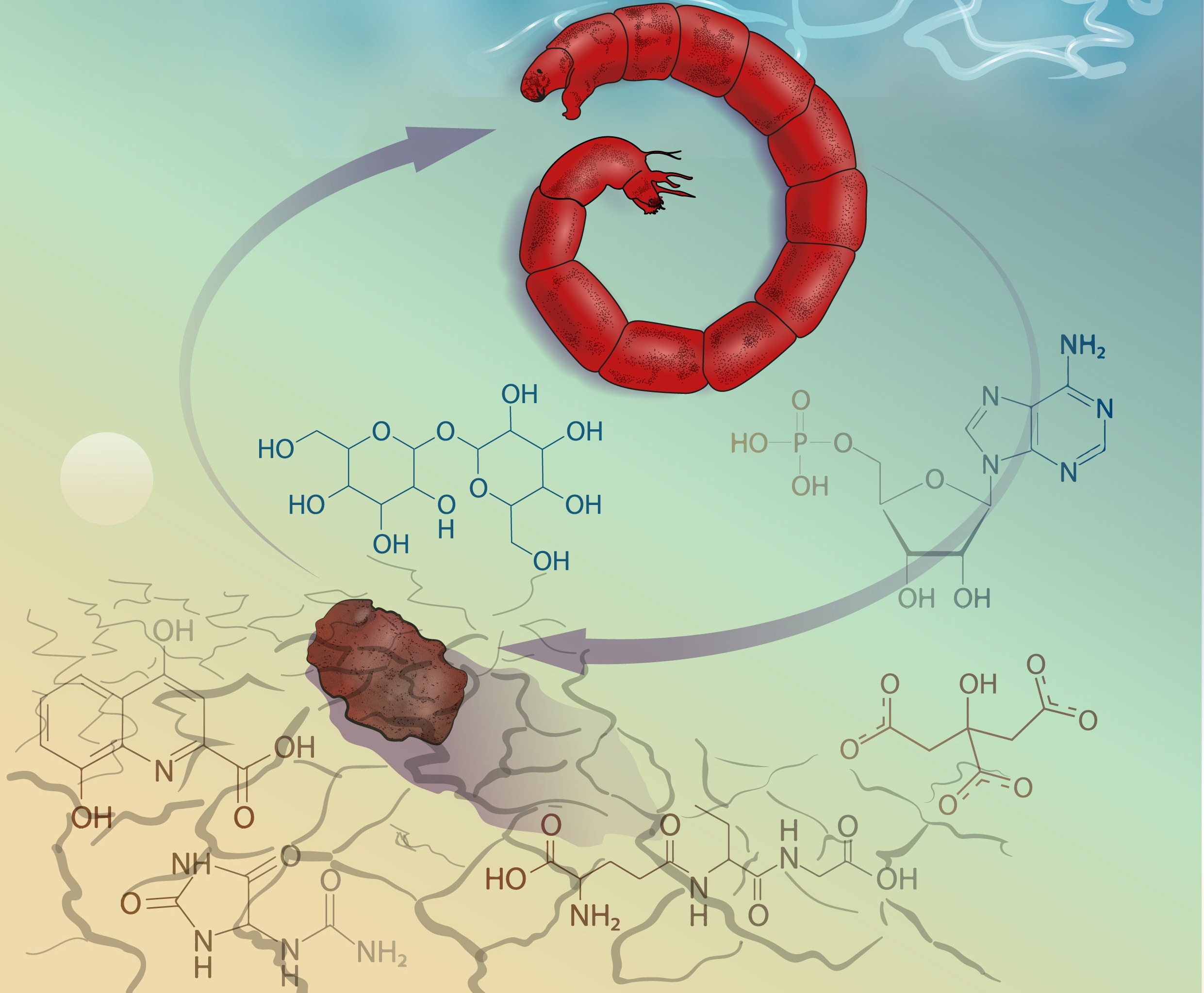
«В процессе эволюции личинки-ангидробионты выработали уникальную стратегию управления метаболизмом, которая позволяет им выживать при почти полной потере воды в организме и успешно восстанавливать все жизненные функции во время регидратации. Одним из компонентов такой стратегии является трегалоза (органическое соединение, углевод из группы невосстанавливающих дисахаридов), чья основная роль, как ранее считалось, заключается в стабилизации молекул и витрификации внутриклеточных структур при дефиците воды. Однако трегалоза обладает еще одной чрезвычайно важной функцией. Она - молекула-носитель энергетических ресурсов. Аккумулированная трегалоза равномерно распределена в организме личинок и легкодоступна в процессе восстановления после ангидробиоза», – отмечает Олег Гусев.
Одновременно происходит синтез и накопление фермента трегалазы, расщепляющего трегалозу. Однако фермент остается в неактивной форме вплоть до момента регидратации. И только с началом регидратации происходит активная переработка трегалозы, которая в первую очередь питает пентозофосфатный путь, вероятно, для восстановления редокс-гомеостаза клеток.
В целом выживаемость личинок после ангидробиоза напрямую зависит от общего количества доступных углеводов (гликоген и трегалоза), что было показано в ходе циклических экспериментов «высушивание-регидратация» на личинках хирономид.
Другие специфические адаптации к высушиванию связаны с усилением антиоксидантной системы и минимизацией токсичных соединений в процессе инициации ангидробиоза. Антиоксидантная система, вероятно, дополнительно усиливается синтезом аналога глутатиона – офтальмовой кислоты, которая, во многом благодаря идентичной глутатиону структуре, выполняет, по всей вероятности, аналогичные функции. Это позволяет экономнее расходовать глутатион в условиях повышенного оксидативного стресса после ангидробиоза.
Уменьшению негативных последствий, связанных с высыханием, способствует также генерация стабильных и нетоксичных соединений. Так, например, продукты азотистого обмена, экскреция которых невозможна во время ангидробиоза, хранятся в виде инертного аллантоина, а детоксикация продуктов обмена триптофана происходит за счет синтеза нетоксичной ксантуреновой кислоты.
О важности последнего процесса (трансаминирование 3-оксикинуренина в ксантуреновую кислоту) для выживания личинок свидетельствует дупликация гена фермента, катализирующего эту реакцию, и расположение обеих копий тандемом в составе так называемого геномного острова ангидробиоза (Anhydrobiosis Related Islands – ARIds). Механизм формирования подобных островов связан с массированной дупликацией и перестановками генов, наиболее полезных для выживания в ангидробиозе (антиоксиданты, белки позднего эмбриогенеза, белки теплового шока и т.д.). Все гены внутри ARId имеют схожий паттерн экспрессии и индуцируются с началом высушивания.
Ничего подобного не было обнаружено у близкородственного неангидробиотического вида хирономид P.nubifer. Это позволяет утверждать, что обнаруженные особенности метаболизма P.vanderplanki напрямую связаны с приспособлением вида к обитанию в условиях периодических засух и способностью личинок впадать в состояние ангидробиоза.

 683
683