Группа ученых из России, Германии и Франции в сотрудничестве с французской фармацевтической компанией NovAliX расшифровала один из механизмов устойчивости золотистого стафилококка, который является причиной большого количества инфекционных заболеваний. Результаты исследований опубликованы в журнале Nature communications.
В статье, авторами которой, наряду с германскими и французскими исследователями, являются сотрудники Института белка РАН и НИЛ «Структурная биология» Института фундаментальной медицины и биологии Казанского федерального университета, описан механизм выживания клеток бактерий во время стресса, когда они переходят в режим энергосбережения, чтобы переждать неблагоприятные условия. Полученные исследователями данные позволят приступить к поиску новых эффективных антибиотиков для лечения стафилококковой инфекции.
Как рассказал нам руководитель НИЛ Структурная биология ИФМиБ, доцент кафедры медицинской физики Института физики КФУ Константин Усачев, на протяжении пяти лет в рамках трехстороннего договора о сотрудничестве между КФУ, Институтом микробиологии Штутгартского университета (Германия) и французским институтом генетики, молекулярной и клеточной биологии (IGBMC, г.Страсбург, Франция), а также совместно с Институтом белка Российской академии наук ведутся исследования функционирования аппарата синтеза белка у золотистого стафилококка. В 2016 году коллективу впервые удалось получить структуру рибосомы золотистого стафилококка в высоком разрешении и показать отличия ее строения в сравнении с другими организмами.
Сейчас ученые заняты поиском и изучением белков, управляющих работой рибосомы патогена. Для этого они используют методы генетики, биохимии, молекулярной биологии и биофизики.
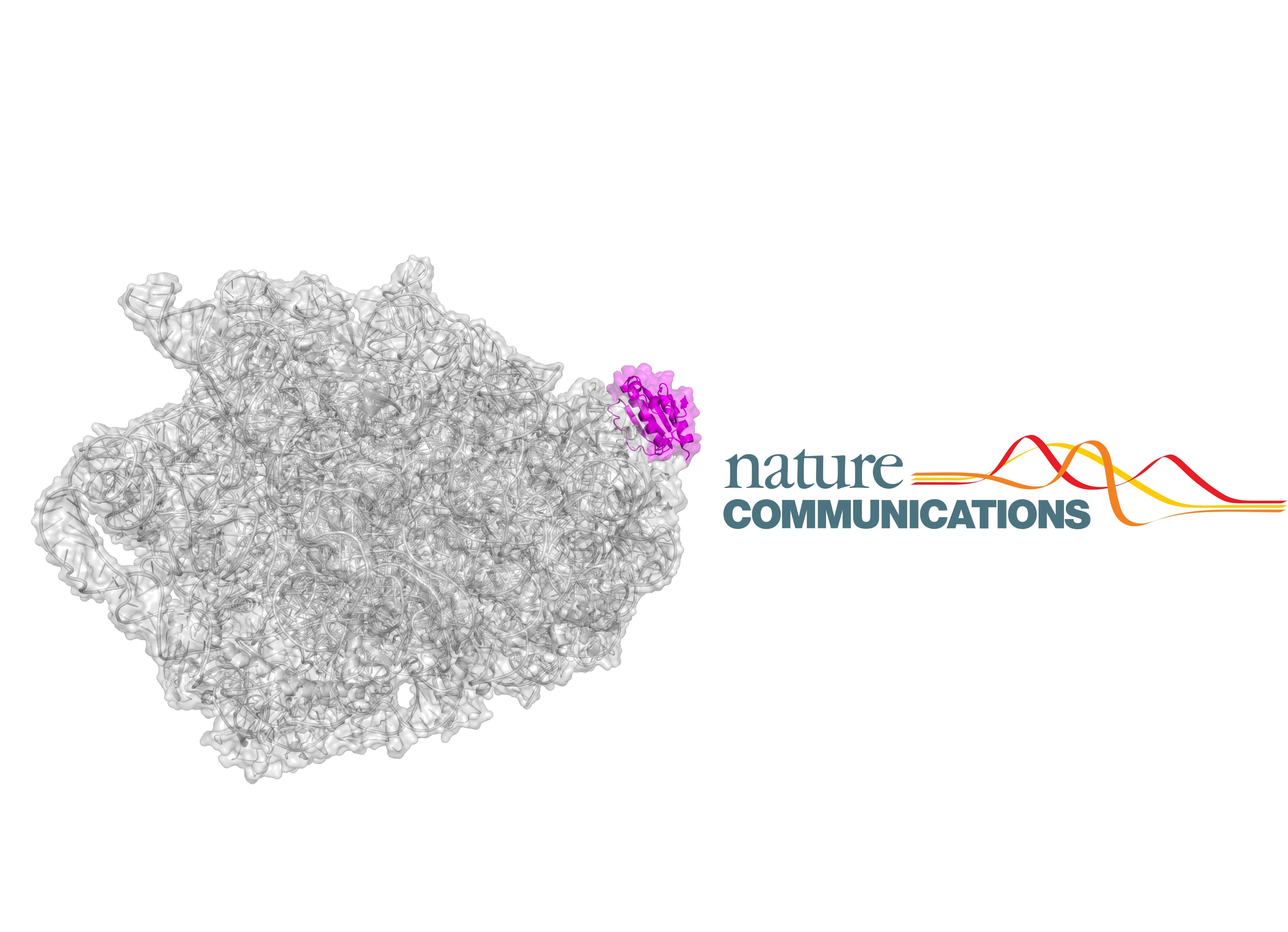
«Рибосома является крупнейшим рибонуклеиновым комплексом в клетке, она состоит из двух субъединиц: большой и малой. Малая субъединица отвечает за прочтение генетического кода, а функция большой субъединицы заключается в обеспечении протекания реакции образования пептидной связи в растущей цепи белка, – объясняет Константин Сергеевич. - В нашей статье с помощью методов криоэлектронной микроскопии и рентгеноструктурного анализа мы смогли показать механизм связывания с рибосомой белка RsfS (Ribosome silencing factor S), который защищает золотистый стафилококк от стрессов (антибиотики, повышенная температура, иммунитет хозяина). В условиях стресса этот белок связывается с большой субъединицей рибосомы и не дает присоединиться малой субъединице, препятствуя формированию функциональных рибосом».
Исследования в этой области ученые начали 5 лет назад. Долгое время им не удавалось получить в высоком разрешении структуру комплекса бактериальных рибосом с белком RsfS, чтобы понять детали его механизма действия.
«Одной из проблем являлась высокая токсичность данного белка на клетки бактерий кишечной палочки E.coli – организма, используемого для получения белков в лабораторных условиях. Дело в том, что белок RsfS, останавливающий синтез белков у золотистого стафилококка, способен останавливать этот процесс и у других бактерий. Это приводило к получению очень малого количества образца белка, недостаточного для проведения структурных исследований. Кроме того, образец был крайне нестабилен и агрегировал. Тогда нам пришла идея - выделить данный белок одновременно с его мишенью в структуре рибосомы стафилококка – белком L14, входящим в состав большой субъединицы. Выяснилось, что если выделять обе компоненты одновременно, то ни будут стабильными в растворе. Нам удалось получить кристаллы этих белков и решить структуру методом рентгеноструктурного анализа сначала со средним разрешением с помощью имеющегося в нашей лаборатории нового монокристального дифрактометра, а затем с высоким разрешением - на синхротроне ESRF в Гренобле (Франция)», - сообщил нам биолог.
Далее ученым потребовалось изучить детали процесса взаимодействия белка RsfS с рибосомой золотистого стафилококка. Сделать это можно было с помощью метода криоэлектронной микроскопии.
«К сожалению, микроскопа, позволяющего решать структуры с высоким разрешением этим методом, в нашем распоряжении не было, но тут нашими исследованиями заинтересовалась французская фармацевтическая компания NovAliX и предложила свой микроскоп для тестирования начальных образцов. Полученные образцы комплексов оказались настолько хорошими, что компания связалась с одним из ведущих мировых производителей микроскопов FEI в Нидерландах и организовала сбор данных на микроскопе Titan Krios. В результате, комбинируя данные криоэлектронной микроскопии с полученными нами ранее данными рентгеноструктурного анализа, нам удалось детально показать молекулярный механизм действия белка RsfS на рибосомы золотистого стафилококка», - рассказал Константин Усачев.
В данное время сотрудники НИЛ Структурная биология совместно с группой хемоинформатиков Казанского университета, которой руководит доцент Химического института КФУ Тимур Маджидов, занимаются предсказанием структуры потенциальных антибиотиков, нарушающих работу белка RsfS и не дающих золотистому стафилококку сберегать свои рибосомы во время стрессовых условий.
По словам Усачева, сегодня только совместными усилиями биологов, химиков и физиков можно выяснить, как устроен аппарат синтеза белка патогенных микроорганизмов. Это необходимо, чтобы создать фармацевтические препараты, которые смогут победить штаммы патогенных бактерий (в том числе золотистый стафилококк), устойчивых ко всем существующим на данный момент антибиотикам.

 689
689